 摘要:
工程抗体格式,如抗体片段和双特异性抗体,相较于传统的全长单克隆抗体(mAbs),具有提供更好治疗效果的潜力。然而,这些非天然分子转化为成功治疗药物的过程可能会受到开发性挑战的阻碍。在此,我们系统分析了64种不同的抗体构建物,针对肿瘤坏死因子(TNF),涵盖了8个不同的分子格式家族,包括全长抗体、各种类型的单链可变片段和双特异性抗体。我们测量了与活性、制造和稳定性相关的15个生物物理特性,采用基于标志的风险评估方法和最新的计算开发性分析工具对变体进行评分。我们的比较评估显示,自然全长抗体格式的整体开发性更高。
双特异性抗体、在轻链C末端具有scFv片段的抗体以及单链Fv抗体片段(scFvs)具有中等的开发性特性,而更复杂的格式,如scFv-scFv、一个Fab被scFv替换的双特异性mAbs和二抗体格式则整体上更具挑战性。
特别是,我们的研究强调了许多当前工程格式在大宗和界面处的碎片化和聚集倾向。
摘要:
工程抗体格式,如抗体片段和双特异性抗体,相较于传统的全长单克隆抗体(mAbs),具有提供更好治疗效果的潜力。然而,这些非天然分子转化为成功治疗药物的过程可能会受到开发性挑战的阻碍。在此,我们系统分析了64种不同的抗体构建物,针对肿瘤坏死因子(TNF),涵盖了8个不同的分子格式家族,包括全长抗体、各种类型的单链可变片段和双特异性抗体。我们测量了与活性、制造和稳定性相关的15个生物物理特性,采用基于标志的风险评估方法和最新的计算开发性分析工具对变体进行评分。我们的比较评估显示,自然全长抗体格式的整体开发性更高。
双特异性抗体、在轻链C末端具有scFv片段的抗体以及单链Fv抗体片段(scFvs)具有中等的开发性特性,而更复杂的格式,如scFv-scFv、一个Fab被scFv替换的双特异性mAbs和二抗体格式则整体上更具挑战性。
特别是,我们的研究强调了许多当前工程格式在大宗和界面处的碎片化和聚集倾向。
1.介绍
截至2024年5月,美国食品药品监督管理局(FDA)已批准127种独特的抗体用于治疗免疫紊乱和癌症等疾病。尽管这些分子中大约80%是典型的单克隆抗体(mAbs),但工程抗体格式正日益受到关注,因为它们提供了与标准免疫球蛋白相比更小分子和更广泛的应用范围的可能性。例如,抗体片段可以开发成多特异性格式,针对同一分子的不同分子或表位,并且由于它们可以在简单的原核生物或酵母系统中高产量表达,因此可能降低完整的制造成本,而典型的mAbs是在哺乳动物细胞系中表达的。此外,较小的抗体片段由于扩散速率更快,有潜力改善组织穿透性,针对实体瘤和眼部适应症。此外,它们在穿越血脑屏障方面更有效,这是针对中枢神经系统(CNS)疾病(如阿尔茨海默病或帕金森病)的药物发现中的主要挑战。与常规mAb格式相比,片段的一个缺点是体内半衰期通常较短,因为它们的体积小,导致在肾脏中被清除,缺乏Fc结构域的延长。然而,目前正在临床测试中,基于白蛋白延长的机制正在开发中,以改善片段的半衰期。
尽管与典型的mAbs相比提供了许多优势,但片段只占FDA批准的抗体的一小部分,其中相对较少的是双特异性抗体(bsAb)。1开发工程构建物的一个主要挑战是它们比全长mAbs的稳定性低,这或许是因为这些分子没有自然进化。特别是,scFv构建物已被证明是有问题的。尽管全长mAbs的开发性已经被广泛探索,但缺乏对替代工程构建物的开发性潜力的系统分析。
在这里,我们比较了针对肿瘤坏死因子(TNF)的64种不同的抗体构建物,涵盖了8个格式家族。我们测量了与活性、制造、短期物理属性和长期稳定性相关的15个生化和生物物理特性,包括一个界面应力测试,以评估表面引起的责任。自然全长抗体在稳定性方面优于工程变体,修改后的格式在大宗和界面上都遭受了不成比例的碎片化和聚集。尽管如此,我们的研究突出了某些格式可以像全长IgG一样稳定,并提供了格式开发性的初始标准化排名。
2.结果
2.1.抗体库的特征
我们基于两种商业抗体格式构建了完整的抗体格式库,即阿达木单抗(hIgG1)和赛妥珠单抗(hIgG1格式),它们都特异性针对肿瘤坏死因子(TNF)。该库包含11种常规IgG抗体,5种scFv化合物,11种串联scFvs,8种二抗体化合物,6种scFv-Fc-scFv化合物,4种scFv-Fc化合物,7种mAb-scFv化合物,4种scFv-Fc与半抗体设计组合的化合物,称为scFv-Fc_HC_LC,以及8种双特异性抗体化合物HC1_LC1_HC2_LC2。通过生成双亲和分子来评估双特异性抗体化合物,其中两个臂都与TNF结合。此外,我们还包括了一个基于抗半抗原抗体的IgG4变体库的对照集,该库涵盖了广泛的溶解潜力,并已进行了先前的特征描述。
抗体库的示意图如图1所示。在11种常规抗体中,差异基于包含在可变域内或Fc区域中的单个突变。
图1. 本研究中使用的73种抗体结构的示意图。我们的抗体库由完整的IgG、片段、双特异性抗体和双特异性片段组成。HzATNP变体(Var1-Var9)之前已有描述,它们在本研究中被用作对照抗体组。双特异性抗体子集(IgG/biAb)包括三种IgG(Var21、Var22和ar23),它们作为对照,并且从技术上讲不是双特异性抗体,因为它们针对单一表位。除了与ATNP结合的HzATNPs外,其余变体均针对TNF-α。注意:一些图像在PDF文件中看起来分辨率较低,但在此在线系统中看起来是正常的。如果最终PDF需要,我们可以提供更高分辨率的图像。
对于含有scFv的分子,生成了带有或不带有稳定突变(Adalimumab VH_R16G_D30S_S49G_S78T_Y101S)的scFv变体,以及带有或不带有插入的稳定二硫键(VH_44C-VL_100C)如Reiter等人所述。
对于需要Fc区域异二聚体化的化合物(biscFv,Fab-scFv-Fc和biAb),引入了knob-in-hole突变以刺激正确的复合物组装。化合物设计在补充数据集S1中描述。
2.2.在发现的初始阶段评估的生物物理特性
我们首先在内部开发的细胞报告基因检测中评估了所有64种TNF结合物,以确认保留了效力(图2a)。所有分子都观察到高效力,证实了所有集合的成功重新格式化。我们注意到与其他格式相比,scFv和scFv-scFv的效力有所提高。
接下来,我们调查了Fc-FcRn相互作用,这对于保证长的体内半衰期至关重要,因为当Fc结构域被细胞内化时,其具有被回收的能力。特别是对于双特异性变体,其中scFvs与重链和轻链的C末端连接的格式,重要的是要确认Fc结构域仍然能够与FcRn受体相互作用。因此,对于所有具有Fc结构域的格式,我们使用表面等离子共振(SPR)分析分析了Fc-FcRn相互作用,观察到重新格式化后没有显著差异(图2b)。
我们还表征了与大规模制造相关的属性,即纯度和纯化后可溶性聚集体的存在,通过尺寸排除高效液相色谱(SE-HPLC)测量。为了比较不同分子的相对性能,我们以我们的控制集HzATNP分子和全长抗体IgGs(从串联scFvs格式化)的平均值作为参考。这些截止值以及以下段落讨论的属性的阈值在表1中总结。在某些情况下,阈值取自文献,而其他属性则基于所有变体的平均值。
如图2c所示,双特异性抗体的特点是纯度低。这可能代表了双特异性抗体开发的挑战,因为需要额外的纯化单元步骤导致成本增加和最终产量降低。
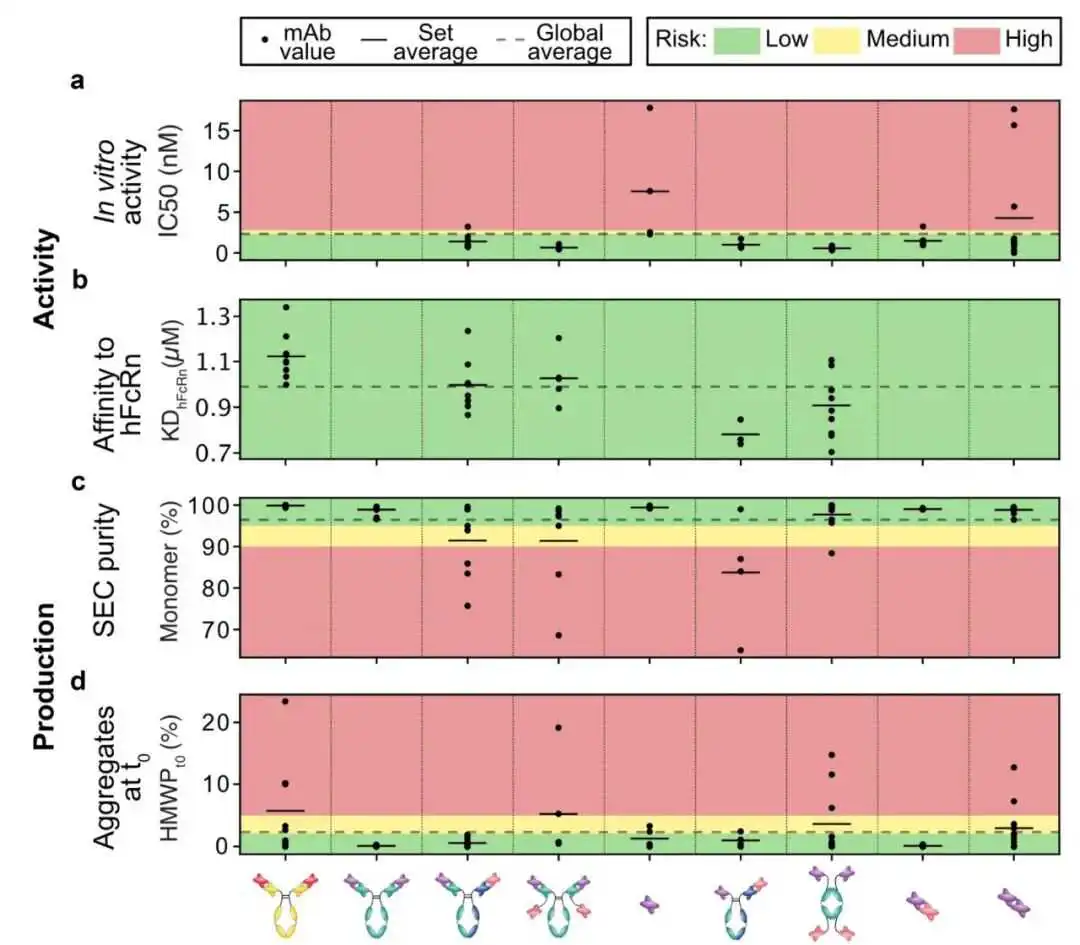
图2. 抗体的生物物理特性。该图展示了在发现的非常早期阶段评估的关键特性。线条表示一组分子内的平均值。虚线代表所有分子的平均值。绿色、黄色和红色背景分别表示根据表1中列出的截止值,行为良好、中等和差。在活性方面没有观察到主要差异。双特异性抗体的特点是纯度低。
2.3.生物物理稳定性特性
接下来,我们表征了几个生物物理特性,这些特性是分子在大宗和界面上的构象和胶体稳定性的指标。这些生物物理特性是分子发生自聚和聚集倾向的总体指标,这些是与单体活性丧失和免疫原性风险增加相关的物理不稳定性问题。所有测试均在高盐配方(His 10 mM, pH 6, NaCl 140 mM)中进行,纳米粒子检测除外,后者在无盐配方(His 10 mM, pH 6)中进行。
我们以熔化温度(Tm)和聚集起始温度(Tagg)来表征传统和双特异性抗体的热稳定性。尽管片段抗体显示出单一转变,但在全长mAbs的Tm测量中观察到两个转变(数据集S2 检测结果)。对于所有抗体变体,我们参考第一个熔化温度,因为从第一次热解链开始发生不希望的产品变化。由于大多数上市抗体的Tm高于60°C,我们认为这些值是定义可开发分子的阈值。低于此阈值的分子被标记为问题分子,而Tm和Tagg在55和60°C之间的分子被认为是中等风险。如图3a,b所示,考虑到这些截止范围,抗体格式之间没有主要差异。
作为胶体稳定性的度量,我们通过动态光散射(DLS)评估了所有分子的自相互作用参数(kd),除了diAbs和scFvs。由于产量非常低,diAb分子没有在所有测试中进行表征。kd与第二维里系数有关,并且在许多情况下是高浓度下抗体自组装的良好预测因子,这可能导致粘度、乳光度、低溶解度、分离等问题。负的kd值对应于净吸引相互作用,而正值表示净排斥自相互作用。在这种情况下,定义表现良好的抗体的阈值被选为-15 ml/g,先前有报道认为这可以识别在高离子强度配方中具有高粘度的分子。
鉴于这个阈值,所有测试的变体都表现良好,尽管全长mAbs的所有集合中具有最高值(图3c)。
我们进行了经典的搅拌应力测试,以评估空气/水界面和流动对抗体稳定性的协同效应,通过测量单体损失来评估(参见材料和方法)。作为阈值,我们选择了所有变体测量的平均单体损失。与之前的测量类似,单体损失高于阈值5%的分子被标记为表现不佳,而具有中间值的变体被认为是中等风险(图3d)。
不同的静电和疏水相互作用。在三种不同类型的纳米粒子存在下测量残余单体损失,疏水带负电荷的、疏水带正电荷的和高负电荷的。纳米粒子的属性摘要显示在表S1中,方法的详细信息描述在材料和方法中。我们根据所有三种纳米粒子测量的平均单体损失定义了总体稳定性评分,平均了不同类型的相互作用(静电和疏水),并使分子排名(图3e)。
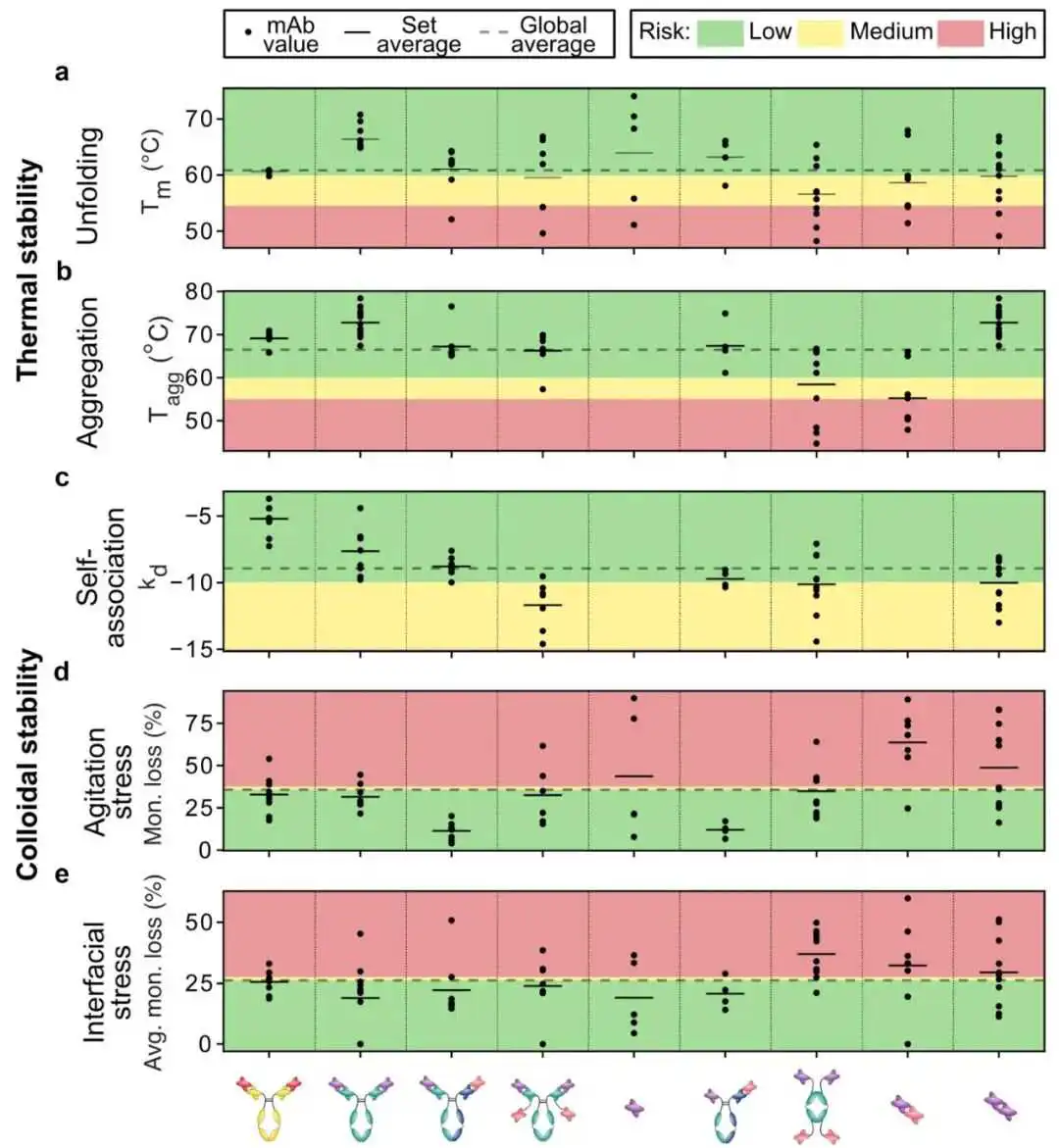
图3. 物理稳定性特性。热稳定性以熔点温度(T_m)表示,自相互作用参数(k_d_m))和聚集起始温度(T_agg)表示的自相互作用稳定性,以及不同分子的胶体稳定性。我们提到所有抗体变体的第一个熔点温度,因为从第一次热解折叠开始就出现了不希望的产品变化。界面稳定性是作为单体在经典搅拌实验中的损失以及在考虑不同类型表面化学性质的纳米粒子实验中的损失来测量的。线条表示一组分子内的平均值。虚线代表所有分子的平均值。绿色、黄色和红色背景分别表示根据表1中列出的截止值,行为良好、中等和差。总体而言,片段在界面应力实验中表现不佳。
如图3所示,分子格式家族在测试参数(Tm,Tagg,kd,搅拌和纳米粒子检测)方面具有不同的值。此外,同一集合内的分子之间观察到很大的变异性。总的来说,典型mAbs的集合具有更均匀的值,并且平均表现优于其他格式。传统抗体与双特异性抗体之间的传播变异性突出了突变对替代构建物与常规抗体相比的更大影响。作为界面应力的进一步评估,我们应用了最近开发的纳米粒子检测,
该检测探测抗体与不同模型表面之间的相互作用,具有不同的电荷和疏水性,因此促进了平均Tm,Tagg,kd和纳米粒子检测的值在不同格式之间相当相似,尽管在diAb和biscFv/biscFv-Fc格式的Tagg中观察到一些责任,在biscFv/biscFv-Fc,diab和scFv格式的搅拌检测中,以及在biscFv/biscFv-Fc,diab和scFv-scFv格式的纳米粒子检测中。平均kd值的差异相当小(Δkd 22 d = 20 mL/g)。
与文献中报告的可能值范围相比(Δkd The spreading of the average values across different formats is higher for the agitation stress assay, with the IgG/biAb and Fab-scFv-Fc formats exhibiting lower monomer losses and scFv, diAb, and scFv-scFv formats showing higher liabilities.
2.4.长期稳定性
最后,整个库的长期稳定性在4°C,30°C和40°C下孵化一年后以碎片化和聚集的形式进行了评估。通过SE-HPLC评估残余单体、片段、可溶性和不溶性聚集体的分数(有关详细信息,请参见材料和方法部分)。在4°C下所有分子均未观察到变化(数据未显示)。在30°C下,大多数变体在聚集方面是稳定的,scFv-scFv片段除外,而几个分子观察到5-8%的碎片化(图4a-c)。
在40°C的加速条件下观察到显著的聚集和碎片化,全长抗体通常比片段和双特异性抗体表现更好(图4d-f)。基于先前的内部观察,抗体片段的显著碎片化可能是由于GS链接器,这可以通过工程优化(例如,通过调整链接器的长度或引入二硫键)或使用计算模型来优化其灵活性。请注意,我们没有评估互补决定区(CDRs)的化学稳定性,例如异构化、脱酰胺和氧化,我们认为这超出了本研究的范围。所有生物物理特性在补充数据集S2中报告。
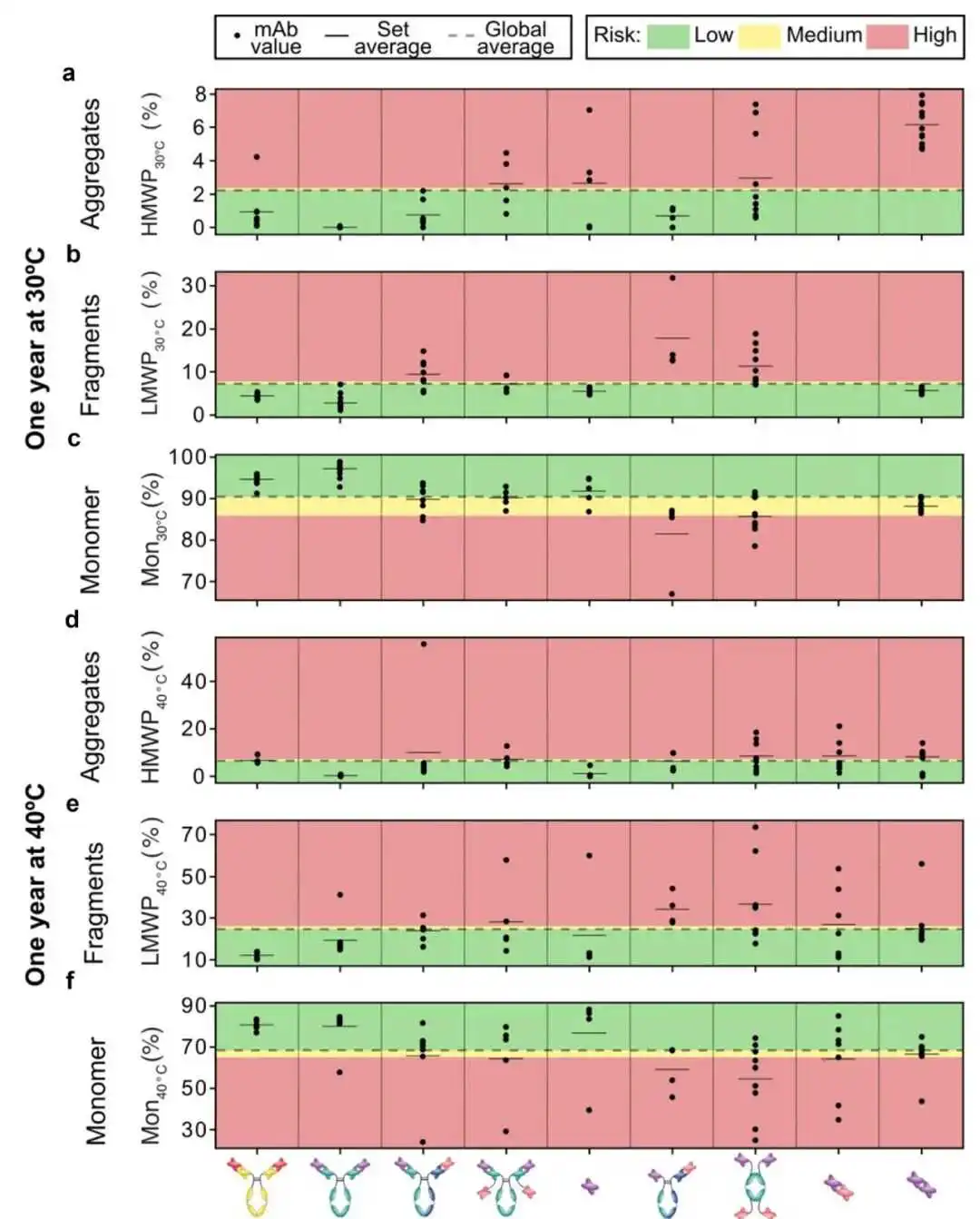
图4. 长期稳定性数据。在30°C和40°C下孵育一年后,测量的聚集体(HMWP)、片段(LMWP)和完整单体(Mon)的百分比。线条表示一组分子内的平均值。虚线代表所有分子的平均值。绿色、黄色和红色背景分别表示根据表1中列出的截止值,行为良好、中等和差。由于产量非常低,diAb变体没有进行所有检测的表征。片段尤其成问题。
在几个格式类别中,在40°C下最高的单体损失观察到的是Humira scFv野生型,对应于scFv格式的Var36,scFv-scFv格式的Var63,以及mAb-scFv biAb格式的Var30。
2.5.实验和计算开发性排名与风险标志方法
前文描述的结果(在补充图S2中总结)显示了不同格式及同一格式内不同突变体之间的行为存在很大的变异性。为了进行定量比较,我们给每个分子分配了一定数量的标志,定义为超出前文描述的定量阈值的生物物理特性的数量,并在表1中总结。图5显示了不同分子集合中标志分布的概览。由于材料可用性低,一些变体无法用所有检测进行分析。因此,展示了标志属性的百分比而不是绝对数量的标志。每组变体都展现出标志的分布,但不同格式之间的分布非常不同。全长IgG的标志数量非常有限。双特异性抗体biAb和scFv具有中等的开发性特性,而mAb-scFvbiAb、双特异性biscFv/biscFv-Fc、片段scFv-scFv和双特异性片段Fab-scFv-Fc以及diAb格式似乎问题更多。图6总结了每个分析属性为每个抗体集合分配的总体标志。这个总结提供了图5显示的标志的正交概览。
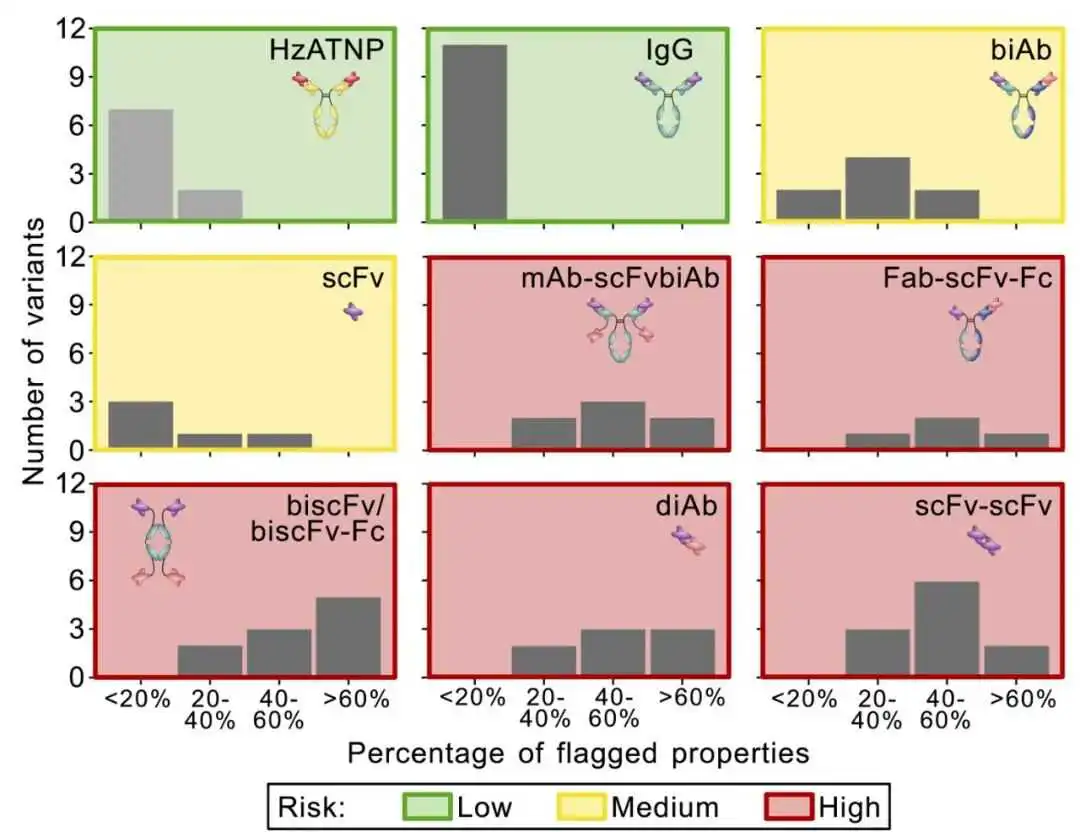
图5. 在不同抗体格式中标记变体的分布。绿色、黄色和红色框架分别表示相应变体集的整体可开发性风险。
此外,我们研究了短时间测量的物理特性(图3)与分子的长期稳定性(图4)之间可能的相关性。如其他研究所观察到的,观察到的相关性很差,没有任何单一属性能够预测变体的长期稳定性(补充图S3)。有趣的是,当集中研究界面检测中可能的相关性时,我们观察到疏水性负电荷纳米粒子检测的结果与所有分子集合的标准搅拌检测之间存在很好的相关性(补充图S4),尽管这种相关性需要在未来用更广泛的分子集合来确认。
最后,我们尝试用治疗性抗体分析器(TAP)工具来合理化这些实验发现,该工具通过将抗体的计算3D生物物理特性与临床阶段治疗分子(CSTs)中观察到的分布进行比较,评估开发性潜力。该工具为每个属性提供了高(红色)、中等(琥珀色)和低(绿色)风险标志(有关更多详细信息,请参阅方法)。基于结构的指标是正电荷斑点(PPC)、负电荷斑点(PNC)、表面疏水性斑点(PSH)和结构Fv电荷对称性参数(SFvCSP)。TAP在区分序列空间接近的变体的行为方面的性能以前没有经过测试,本研究中调查的变体相对于所有CSTs显示出低序列多样性。尽管存在这些限制,TAP与生化和生物物理检测之间观察到了一定程度的一致性。具体来说,在所有变体中,TAP为四个基于结构的指标中的三个(PPC、PNC和PSH)分配了绿色标志(补充图S5)。然而,对于SFvCSP,78%的变体被预测为中等风险,3%为高风险,其余19%为低风险。这表明变体主要占据了风险开发性空间,与实验检测一致,所有变体都被高度标记。此外,SFvCSP标志与纳米粒子检测最为一致,特别是与负电荷和正电荷纳米粒子检测(补充图S6)。
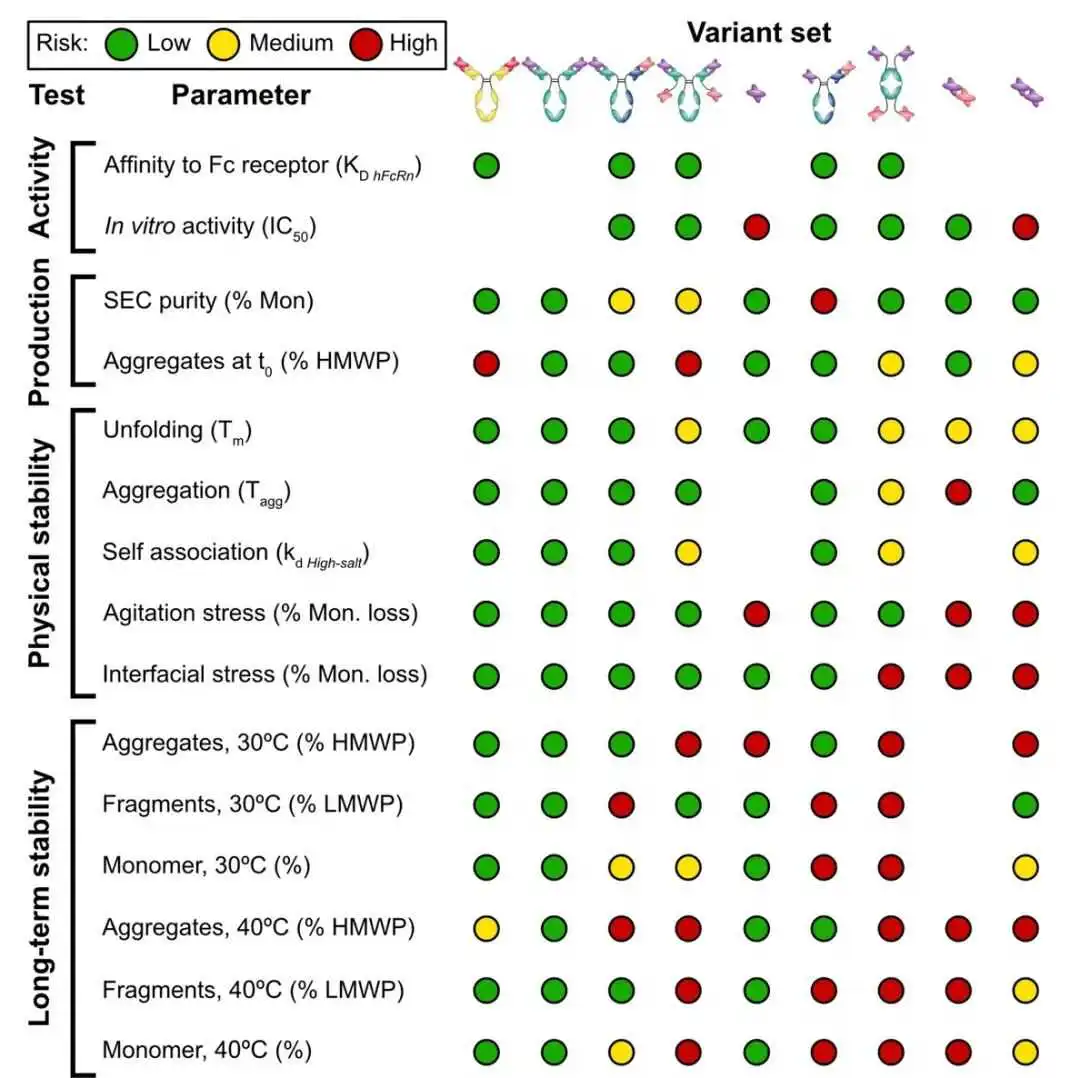
图6. 基于生物物理性质的可开发性风险评估。对整体可开发性风险影响更大的实验是长期稳定性研究以及胶体和界面稳定性研究。双特异性片段和片段显示出最不利的可开发性概况。
我们还研究了TAP是否能预测实验观察到的抗体格式之间的开发性差异。没有看到明确的趋势。这与TAP仅评估Fv区域的属性一致,以及TAP的标志阈值是基于所有可用的I期后CSTs确定的,这些CSTs主要由整个mAb格式主导,降低了对格式特定模式的敏感性。
3.讨论
除了新的常规抗体进入临床测试外,较小的抗体格式越来越受欢迎。相关的例子包括VHH和其他小的de novo亲和配体,以及涉及Fc结构域的许多其他例子。我们的工作表明,平均而言,替代构建物的不稳定性高于传统抗体,特别是在聚集和碎片化方面。此外,不同格式家族之间的责任类型可以大不相同。这些见解突出了当前抗体开发性评估领域必须解决的一些重要挑战,以实现未来对替代框架的开发性预测。
与传统抗体相比,新的分子格式本身带来了缺乏队列实验数据的挑战。我们的工作代表了填补这一空白的重要一步,并促进了未来对新兴新格式进行定量比较的系统研究。我们还表明,开发性潜力强烈依赖于格式,并且作为片段不稳定的分子(例如,scFv Var36)可以通过突变(例如,scFv Var38)进行优化,或者以另一种格式(例如,阿达木单抗IgG Var10-Var20)开发。
目前尚不清楚为全长抗体开发的计算开发性工具是否会转移到其他分子格式。近年来,在传统抗体IgG格式的开发性计算预测方面取得了显著进展。这一进展增加了用较少需求和准确的计算预测取代(或至少减少)资源密集型的实验开发性读数的潜力。此外,对标准化开发性方法的关注增加,有望导致具有公开抗体序列的更大比较研究,这最终将支持开发和评估计算工具的发展和评估。在我们的工作中,我们已经展示了计算预测器TAP,它已经对全长抗体格式进行了很好的验证,但在预测这里测试的衍生格式的开发性问题方面存在局限性,尽管TAP与生化和生物物理检测之间观察到了一定程度的一致性。此外,替代格式通常与其他蛋白域融合,以实现例如多特异性功能和体内半衰期延长,这进一步复杂了模型构建。
总之,我们通过测量描述活性、生产、构象和胶体稳定性以及长期稳定性的15种不同的生物物理特性,对表达在9种不同格式中的73种mAbs进行了表征。通过为每个生物物理特性定义阈值,进行了相对的定量比较。不同格式的特征是标志的分布和开发性概况不同(图5)。总体开发性潜力对于传统全长抗体更高,对于双特异性和串联片段则降低。具体来说,双特异性biAb和mAb-scFvbiAb以及片段scFv表现出中等的开发性特性,而双特异性biscFv/biscFv-Fc、片段scFv-scFv和双特异性片段Fab-scFv-Fc以及diAb格式揭示了大量的标志。不同属性之间的相关性很差,没有任何单一属性能够预测变体的长期稳定性。尽管全长抗体的表现优于工程变体,但这项工作突出了某些格式可以几乎和全长抗体一样稳定,并提供了格式开发性的初始标准化排名。
4.材料与方法
4.1.抗体变体表达与纯化
用于生产所有抗体格式的表达质粒均从Geneart/Life Technologies购买。scFv变体、串联scFv和二价抗体格式设计时均带有C末端HPC4标签,以便于纯化。scFv构建物设计时使用21个氨基酸残基长的甘氨酸-丝氨酸连接子(SGGGGSGGGGSGGGGSGGGGS)来分隔VH和VL结构域。对于串联scFv构建物,两个scFv部分通过25个氨基酸残基的甘氨酸-丝氨酸连接子(GGGGSGGGGSGGGGSGGGGSGGGGS)连接;对于二价抗体构建物,设计时采用以下设置:VH1-GGGGS-VL2-GGGGSGGGGSGGGGS-VH2-5GS-VL1。所有蛋白均通过Expi293细胞瞬时转染表达,遵循制造商的指导(Expi系统,Life Technologies)。使用亲和色谱法首先从细胞培养上清中纯化蛋白,使用针对HPC4的亲和树脂(针对scFv、串联scFv或二价抗体)或基于蛋白A的树脂用于含Fc的构建物。随后,分子通过Superdex200尺寸排除纯化步骤进一步纯化,操作HiTrap MabSelectSure和HiLoad 26/600 Superdex 200柱,根据制造商的描述(Cytiva,目录号和28,989,336)。HPC4柱和纯化协议在Novo Nordisk内部建立,基于使用Expi203系统重组生产的针对HPC4的抗体,并根据制造商的描述将纯化的抗体偶联到CNBr活化的Sepharose 4 Fast Flow树脂(Cytiva,目录号)。蛋白在尺寸排除流动缓冲液中准备:20 mM Hepes,150 mM NaCl,pH 7.4。所有分子均经过质量控制分析,包括SDS-PAGE、SE-HPLC和完整质量LC-MS。然后所有分子使用离心过滤器进行缓冲液交换至10 mM His,pH 6,140 mM NaCl,浓度基于UV280测量确定。
4.2.体外活性(细胞报告基因检测)
使用基于HeLa细胞的报告基因检测(Novo Nordisk,内部)来通过测量TNF抑制来确定抗体的功能。当TNF与TNF受体结合时,NF-κB信号被激活,这在该细胞系中诱导了萤火虫荧光酶的转录和细胞内产生。荧光酶可以用来通过添加其底物(甲虫荧光素)和监测由此产生的光发射来量化TNF抑制的数量。
在第1天,HeLa细胞在50 ml磷酸盐缓冲液(PBS;Gibco 14,190–094)中洗涤,以1200 rpm旋转5分钟并重新悬浮在1 ml含DMEM+GlutaMAX(Gibco 10,569–010)、10% FBS(Gibco 01,190,009 M)、10 mM Hepes(Gibco 15,630–056)和5 ml Glutamax(Gibco 35,050,061)的检测培养基中。细胞在ViaCell上计数,用检测培养基稀释并种植在96孔板(Perkin Elmer 6,005,680)中。每个孔中种植100 μl培养基含有2×10^5个细胞。板在37°C含5% CO2下过夜孵育。
在第2天,从板中移除培养基并向细胞中添加50 μl抗体样本。事先从100 nM开始使用检测培养基对每种抗体进行四倍稀释,并进行技术三次重复。细胞和抗体在37°C下孵育30分钟,然后向每个孔中添加50 μl 0.5 ng/ml TNF(R&D Systems,210-TA)。每个板上保留1-2列作为对照,其中只向三倍稀释中添加TNF。板在37°C下孵育4小时,为细胞提供足够的时间表达荧光酶。向每个孔中添加100 μl Steady-Glo(Promega,E254B),并在黑暗中孵育15分钟。在此期间,细胞被裂解,底物甲虫荧光素被报告酶萤火虫荧光酶催化。在EnVision平板阅读器上测量由此产生的发光。
使用GraphPad Prism分析荧光素酶细胞检测的发光信号。信号强度与抗体浓度作图,并使用对数x轴进行可视化。为了估计最大抑制的一半浓度,将浓度转换为对数(浓度),并将读数拟合到具有四个参数和可变斜率的剂量-反应曲线。在不是所有变体都达到底部平台的情况下,拟合是在共享顶部和底部的限制下进行的。Prism自动计算IC50,作为顶部和底部平台之间的中点浓度,使用以下公式:
4.3.亲和性对人类Fc受体
由于biscFv/biscFv-Fc (Var45 – Var54)蛋白缺乏可以作为捕获设置中亲和标签的轻链,我们通过胺偶联将它们和抗三硝基苯酚(ATNP)hIgG4 (S214P)固定在传感器芯片上。为此,先将这些抗体在10 mM醋酸钠(pH 4.5)(Cytiva Life Sciences,目录号BR)中稀释至3–8 µg/ml,然后固定在CMD50L传感器芯片(XanTec Bioanalytics GmbH)的流动室2、3或4上,使用1× HBS-EP+ (pH 7.4) (Cytiva Life Sciences,目录号BR-1006-69)作为流动缓冲液,固定至大约100 RU。尽管ATNP hIgG4(S214P)是常规的hIgG4格式,但它被作为对照样本固定在抗体侧。流动室1用作参考流动室,因此此流动室内没有固定抗体。接下来,将hFcRn外域稀释至6400 nM并进行两倍连续稀释,注入每个流动室90秒,以允许hFcRn外域与这些固定的抗体结合,随后解离hFcRn外域90秒。1× CBS-EP-CMD (pH 5.6)和1× PBS-EP+-CMD (pH 7.4)被用作hFcRn外域的稀释缓冲液和每个结合周期中的流动缓冲液,流速为20 µl/min。每个结合周期后,传感器芯片通过两次连续60秒注入1× PBS-EP+ (pH 7.4)进行再生,流速为30 µl/min。这种再生程序使流动室表面的抗体保持完整,而结合的hFcRn外域被移除,允许新的hFcRn外域样本在下一个周期中结合。
其他抗体具有可以作为捕获设置中亲和标签的轻链。作为捕获试剂,F(ab’)2抗人IgG (Fab特异性) (Sigma-Aldrich,目录号I3266)通过胺偶联固定在传感器芯片上。为此,先将此F(ab’)2在10 mM醋酸钠(pH 4.5)(Cytiva Life Sciences,目录号BR)中100倍稀释,然后固定在CMD50L传感器芯片的流动室1、2、3和4上,使用1× HBS-EP+ (pH 7.4)作为流动缓冲液,固定至大约1500 RU。接下来,将这些抗体稀释至10–25 µg/ml,然后注入流动室2、3或4中30秒,流速为10 µl/min,以允许这些抗体捕获至70–400 RU。ATNP hIgG4(S214P)被作为对照样本在抗体侧捕获。流动室1用作参考流动室,因此此流动室内没有捕获抗体。捕获步骤之后,将hFcRn外域稀释至6400 nM并进行两倍连续稀释,注入每个流动室90秒,以允许hFcRn外域与这些捕获的抗体结合,随后解离hFcRn外域90秒。1× CBS-EP+ CMD (pH 5.6)和1× PBS-EP+-CMD (pH 7.4)被用作抗体和hFcRn外域的稀释缓冲液和每个结合周期中的流动缓冲液,流速为20 µl/min。每个结合周期后,传感器芯片通过两次连续20秒注入10 mM甘氨酸-HCl (pH 1.7) (再生溶液在试剂盒中,Cytiva Life Sciences,目录号BR)进行再生,流速为30 µl/min。这种再生程序使流动室表面的F(ab’)2抗人IgG (Fab特异性)保持完整,而捕获的抗体被移除,允许新的抗体样本捕获和新的hFcRn外域样本在下一个周期中结合。
在固定步骤中,流动室1、2、3和4中的传感器芯片表面在固定任何蛋白之前通过100 mM N-羟基琥珀酰亚胺(NHS)和400 mM N-乙基-N’-二甲基氨基丙基羧二胺盐酸盐(EDC)等体积混合后激活,并通过1 M乙醇胺盐酸-NaOH (pH 8.5)在蛋白固定后封闭。NHS、EDC和乙醇胺来自胺偶联试剂盒,2型 (Cytiva Life Sciences,目录号BR)。
1× PBS-EP+-CMD (pH 7.4)缓冲液是通过将0.5 M EDTA (pH 8.0) (Invitrogen,目录号)稀释至3 mM和溶解羧甲基葡聚糖 (CMD) (Sigma-Aldrich,目录号86524-100 G-F)至1 mg/ml在1× PBS-P+ 1× CBS-EP+中准备的 (Cytiva Life Sciences,目录号)。-CMD (pH 5.6)缓冲液是通过将0.5 M EDTA (pH 8.0)稀释至3 mM,将10% (v/v) 表面活性剂P20 (Cytiva Life Sciences,目录号BR)稀释至0.05% (v/v),溶解CMD至1 mg/ml,溶解柠檬酸钠至10 mM和溶解氯化钠至150 mM,随后用约10 M HCl调节pH至5.6来准备的。
亲和力(平衡解离常数,KD)是通过使用Biacore T200评估软件2.0 (Cytiva Life Sciences)中的1:1结合模型对结合曲线进行稳态拟合来确定的。每个相互作用在两个不同的传感器芯片上进行了两次独立的重复测试。计算了每个相互作用的平均KD值。平均KD值的误差条计算为两个重复测试的KD值差异的一半(diff/2),如果diff/2大于两个重复测试拟合KD值的标准误差(SEs)或一个重复测试拟合KD值的较大SE,则为较大SE。
通过在NanoTemper的Prometheus NT.48系统(NanoTemper, PR001)上进行纳米差示扫描荧光测量(nanoDSF),测量了每个变体的熔点温度(Tm)和开始聚集的温度(Tagg)。样品的准备是通过用标准毛细管(NanoTemper, PR-C006)填充10μL的1 mg/mL蛋白溶液。在从20°C加热至90°C的过程中,以1°C/min的温度梯度,测量了330 nm和350 nm处的内在色氨酸荧光。数据使用NanoTemper PR Control软件进行分析。Tm是从350 nm和330 nm荧光比值的一阶导数最大值中得出的。
Tagg与Tm在同一平台上并行测定,通过测量不同温度下的光散射来确定。使用Python脚本进行数据分析以确定Tagg。数据通过S形曲线拟合,聚集的起始点被定义为相对于过渡前基线的散射信号已达到曲线振幅的10%的温度。
使用动态光散射(DLS)测量了自相互作用参数(kd),如Dingfelder等人所述。45 简而言之,在高盐缓冲液(10 mM His, pH 6, 140 mM NaCl)中,以1至20 mg/ml的不同蛋白浓度测量了扩散系数。将每种蛋白稀释液的20μl分装在384孔板(Corning 3540)中,并用透明箔(ClearSeal)封口。在25°C下,使用板式阅读器(Wyatt DynaPro)测量前,将板子离心(1500 rpm, 5分钟)。kd是根据扩散系数D与蛋白浓度c之间的线性关系计算得出的:
D₀是在无限稀释时的扩散系数。
在高盐缓冲液(10 mM His, 140 mM NaCl, pH 6)中准备了变体的库存溶液(0.5 mg/ml)。将每个样品的100 µl分装在四份1.5 ml螺旋盖小瓶(透明)(BGB, 32 × 11.6 mm)中,并用Parafilm封口。样品在1400 rpm和25°C下摇动4小时,然后立即转移到1.5 ml的Eppendorf管中。作为对照,还分析了在停滞条件下孵育的样品的两个重复。将四个Eppendorf管离心1.5小时,转速为17,200 rpm。然后使用Nanodrop仪器测量所有样品上清液在280 nm处的吸光度两次。使用以下公式计算由于搅拌压力导致的单体损失:
其中 Absref 和Abssample 分别是在没有搅拌和有搅拌的情况下测量的吸光度值。
纳米粒子是通过乳液聚合法合成的,如前所述。${}^{32,33}$ 简而言之,正电荷和负电荷的纳米粒子分别由甲基丙烯酸甲酯(MMA, Sigma Aldrich, 99%)和[2-(甲基丙烯酰氧基)乙基]-三甲基氯化铵$\left(MA-Ch^{+}\right.$, Sigma-Aldrich, 80% 水溶液)或3-磺丙基甲基丙烯酸钾盐(MA-$SO^{-}$, Sigma-Aldrich, 98%)在蒸馏水中合成。2,2'-偶氮双(2-乙基-丙酰胺)二盐酸盐(V50, Sigma-Aldrich, 97%)或过硫酸钾(KPS, Merck)分别用作正电荷和负电荷纳米粒子的自由基引发剂。
具有残余负电荷的疏水性纳米粒子$\left(Hb^{-}\right)$是由丁基丙烯酸酯(BA, Sigma-Aldrich, 99%)作为疏水单体,在十二烷基硫酸钠(SDS, Sigma-Aldrich, 99.85%)和水的存在下合成的。同样使用BA以及$MA-Ch^{+}$作为稳定剂,结合叔丁基过氧化氢(tBuOOH, ABCR, 70%)和抗坏血酸(AsAc, Fisher Chemicals)作为自由基引发剂,也制备了具有残余正电荷的疏水性纳米粒子$\left(Hb^{+}\right)$。
纳米粒子测定是如先前描述的那样进行的。${}^{32}$ 简而言之,抗体变体以1:1的比例与纳米粒子在1.5 ml的反应管(Eppendorf)中混合,以达到最终抗体浓度为0.5 mg/ml。纳米粒子以25:1的表面比例(蛋白到纳米粒子)引入。由于纳米粒子在更高盐浓度下的胶体不稳定性,所有纳米粒子测定都在无盐缓冲液$(10 mM$ His pH 6)中进行。
在室温下孵育溶液30分钟后,引入$50 mM MgCl_2$以破坏蛋白质和纳米粒子的悬浮液。然后将混合物转移到滤板(Corning 96孔滤板)中,并在20°C下以2500 rpm的速度离心30分钟。然后在Nanodrop分光光度计(3917 Lite, ThermoScientific)上测量滤液在280 nm处的吸光度,每个样品进行两次测量。每个配方的实验都进行了两次,此外,还测量了两个在没有纳米粒子的情况下的参考样品。为了计算背景,还测量了没有蛋白质的纳米粒子的对照样品,也进行了两次测量。单体损失的百分比是使用以下公式计算的:
其中 Absref 和Abssample 是在没有纳米粒子和有纳米粒子的情况下分别测量的吸光度值。
尽管纳米粒子测定是在无盐配方(10 mM His, pH 6)中进行的,其他的生物物理参数是在标准高离子强度配方(10 mM His, 140 mM NaCl, pH 6)中确定的。这种差异可能会影响到不同测定之间的相关性。
每个变体的六个重复样品,每个100 µl,浓度为1 mg/ml,被孵育在HPLC玻璃瓶(BGB, 32 × 11.6 mm)中,分别在4°C、30°C和40°C下。准备了三个对照样品,其中两个立即用SE-HPLC测量,第三个在-80°C下冷冻保存。
孵育一年后,样品通过注射到一个尺寸排除柱(TSK G3000 SWXL, Tosoh Bioscience)上,该柱安装在安捷伦HPLC系统上进行分析。样品在20°C的柱温和0.8 ml/min的流速下分析25分钟,使用122 mM Na2HPO4、78 mM NaH2PO4、300 mM NaCl、4% 2-丙醇在pH 6.8下的溶液作为流动相。
单体、聚集体和片段的峰面积是通过SEC色谱图在孵育前后测量确定的。由于溶剂蒸发,一些样品的SEC色谱图的总面积在孵育一年后增加了。为了考虑这一点,单体、片段和可溶性聚集体的各个面积被标准化到一年孵育后的总面积。这种方法忽略了无法进入柱子的不溶性聚集体的形成,因此估计的单体转化率是下限。以下方程用于计算在30°C和40°C下孵育一年后的聚集体、片段和完整单体的百分比:
所有抗体变体的Fv区域都使用ABodyBuilder2进行了结构建模并去除了所有氢原子。然后通过TAP运行模拟结构计算五个可开发性指标——总IMGT CDR长度,使用Kyte和Doolittle尺度的PSH,PPC,PNC和SFvCSP。PSH,PPC和PNC指标是基于CDR附近残基定义的,即IMGT定义的CDR位置±2个残基内的任何残基,以及在4.5 Å内任何其他表面暴露的残基。我们使用TAP中的四个基于结构的指标(PSH,PPC,PNC和SFvCSP)为每个抗体分配高(红色),中等(琥珀色)或低(绿色)风险标志。琥珀色和红色标志的阈值是根据临床阶段治疗药物(CSTs)在最新的TAP更新论文中报告的分布来定义的。对于双特异性格式,每个独特的Fv区域都单独进行了结构建模并分配了可开发性标志,并且我们为每个指标分配了该变体的最高风险标志。
识别微信二维码,添加抗体圈小编,符合条件者即可加入抗体圈微信群!
本公众号所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,不希望被转载的媒体或个人可与我们联系(),我们将立即进行删除处理。所有文章仅代表作者观点,不代表本站立场。
到此这篇wacc和apv和fte的比较(apc和fitc)的文章就介绍到这了,更多相关内容请继续浏览下面的相关推荐文章,希望大家都能在编程的领域有一番成就!


















